بیماری های انسدادی ریه (قسمت ۱)
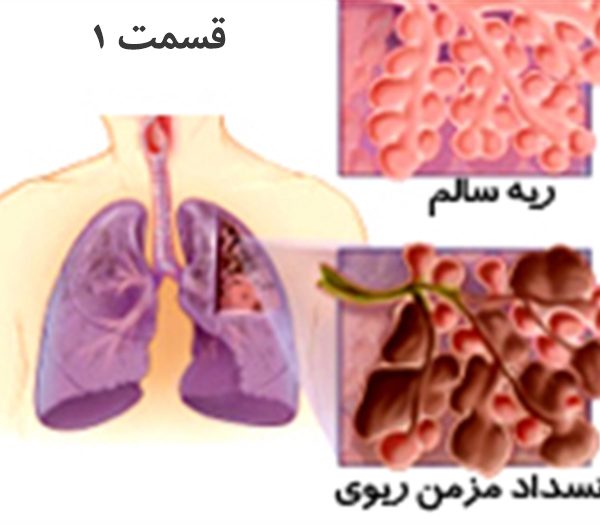
مقدمه
بیماری های انسدادی ریه گروهی شایع از اختلالات ریوی هستند که باعث تنگی نفس با مشخصه ی الگوی انسدادی محدودیت جریان هوای بازدمی در اسپیرومتری می شوند. این اختلالات در بر گیرنده بیماری انسدادی مزمن ریه(COPD)، آسم، فیبروز کیستیک (CF)، برونشکتازی، و بیماری های برونشیولی می باشند.
در بعضی موارد این اختلالات از نظر بالینی با هم هم پوشانی دارند و گذشته از محدودیت جریان هوای بازدمی، خصوصیات مشترکی دارند. این خصوصیات شامل علایم خس خس و تولید التهاب مزمن راه های هوایی مرکزی، وجود تغییرات ساختمانی در راه هوایی که سبب سازمان دهی مجدد (remodeling) راه های هوایی و حملات تشدید موقتی وضعیت بالینی ( exacerbation ) می شود. اما علل بیماری ها، محل درگیری و الگوی تغییرات التهابی و سازماندهی مجدد و همچنین درمان ها ، پیش آگهی ها و سیر طبیعی بیماری ها اغلب تفاوت های واضحی دارند که سبب می شود افتراق بالینی این بیماری ها از هم مهم باشد.
طبقه بندی بیماری های انسدادی ریه
طبقه بندی بیماری های انسدادی ریه ، گرچه اغلب بیماران مبتلا به (COPD) بیماری راه های هوایی کوچک دارند، اختلالات برونشیولی هیچ هم پوشانی با COPD ندارد. CF فیبروز کیستیک.
مشخصه ی COPD در کل التهاب غیر طبیعی راه هوایی و ساختمان غیرطبیعی ریه در پاسخ به یک محرک استنشاقی است که به طور معمول دود سیگار است و باعث محدودیت غیرقابل برگشت یا قابل برگشت نسبی جریان هوا می گردد و معمولا به مرور پیشرونده است. آسم با ویژگی شاخص واکنش دهی بیش از حد عضله ی صاف برونش و محدودیت قابل برگشت جریان هوا، سیر بالینی متغیر و به وسیله ی همراهی معمول آن با آتوپی از COPD تمایز داده می شود.
این بیماری ها در جمعیت عمومی همه گیر بوده و مسئول بخش عظیمی از مرگ و میر و عوارض مرتبط با بیماری های انسدادی ریه می باشند. برونشکتازی یک اتساع غیر طبیعی و دائمی برونش است که سبب سرفه ی مزمن، تولید خلط چرکی و هموپتزی می شود؛ اختلالات گوناگونی عامل آن هستند. مثل CF که یک اختلال ژنتیکی ناشی از جهش در ژن CFTR است. اختلالات برونشیولی که اختلالات راه های هوایی کوچک هم نامیده می شود ناشی از التهاب / یا فیبروز راه های هوایی کوچک ریه است که منجر به تنگی نفس می شود. تشخیص این اختلال دشوار است چون برای ظهور محدودیت جریان هوای بازدمی در اسپیرومتری، اکثر راه های هوایی کوچک باید از بین رفته یا مسدود شده باشند.
Human Body Organs (Lungs); Shutterstock ID 396426208
تفاوت های انسداد جریان هوای بازدمی
اساس انسداد جریان هوای بازدمی در بین این بیماری ها متفاوت است. جریان یافتن هوا خلال درخت برونشی نسبت مستقیم با فشار پیش راننده و نسبت عکس با مقاومت دارد. در بیماری انسدادی ریه تغییر در یک یا هر دوی این فرایندها ممکن است وجود داشته باشد. عدم وجود بافت ارتجاعی، که معمولا در COPD وجود دارد، سبب محدودیت جریان هوا به علت کاهش خاصیت برگشت ارتجاعی می شود که منجر به کاهش فشار پیش راننده می گردد.
برعکس در آسم، محدودیت جریان هوا ناشی از انقباض برونش هاست که مقاومت راه های هوایی را افزایش می دهد. افزایش مقاومت راه هوایی در COPD هم وجود دارد که دلیل آن التهاب و فیبروز راه های هوایی کوچک است و همچنین روی هم خوابیدن راه های هوایی کوچک که به دلیل فقدان بافت ارتجاعی دورادور آنها رخ داده است. در همه بیماری های انسدادی، انسداد مجاری هوایی با موکوس به افزایش مقاومت راه های هوایی کمک می کند.
بسته شدن راه های هوایی باعث چه تغییراتی در ریه ها می شود؟
بسته شدن راه هوایی در مقابل جریان هوا باعث تغییرات شاخصی در حجم های ریوی می گردد. حجم باقی مانده و ظرفیت باقی مانده ی عملکردی افزایش می یابند در حالیکه ظرفیت کل ریه طبیعی باقی مانده با افزایش می یابد. ظرفیت حیاتی و به ویژه ظرفیت دمی سرانجام در اثر افزایش حجم باقی مانده کاهش می یابد. چندین عامل ممکن است در افزایش ظرفیت باقی مانده عملکردی و حجم باقی مانده در بیماری انسدادی ریه دخیل باشند. کاهش برگشت پذیری ارتجاعی ریه در COPD به علت کاهش تقابل در برابر نیروی رو به خارج وارد شده توسط جدار قفسه ی سینه ظرفیت باقی مانده عملکردی را افزایش می دهد.
از بین رفتن قوام راه های هوایی و کاهش کشش از اطراف توسط ریه ی احاطه کننده ی مجاری در COPD، همچنین انقباض برونشها و بسته شدن توسط توپی موکوسی در حمله حاد آسم باعث می شود تا مجاری هوایی در حجم های ریوی بالاتری روی هم خوابیده و هوای بیشتری به دام اندازند. نهایتا، تحت شرایط نیاز بیشتر برای افزایش تهویه در دقیقه مثلا در حین ورزش، افزایش مقاومت در مقابل جریان هوا ممکن است اجازه تخلیه کامل ریه ها در زمان قابل دسترسی برای بازدم را نداده و منجر به اصطلاحا اتساع بیش از حد دینامیک ریه ها سود چراکه حجم هوای به دام افتاده به تدریج افزایش می یابد در حالیکه ظرفیت دمی به تدریج محدودتر می گردد. این پدیده است بروز علایم سفتی قفسه سینه و تنگی نفس در طی ورزش می شود و منجر به محدودیت ورزش به ویژه در COPD می شود.
دو نتیجه ی عمده ی تغیرات حجم ریه که در بیماری انسدادی ریه دیده می شوند عبارتند از:
۱) تنفس در حجم های ریوی بالاتر مستلزم تغییرات بیشتر فشار برای تغییر مشابه در حجم ریه بوده و این امر موجب افزایش کار تنفس می گردد.
۲) حجم های ریوی بالاتر عضلات دمی را از نظر مکانیکی در وضعیت نامطلوب قرار می دهند، دیافراگم مسلح شده در نتیجه قابلیت آن برای تغییر دادن حجم داخل قفسه ی سینه کاهش می یابد، و همه ی الیاف عضلات دمی کوتاه شده و مقدار فشاری را که قادر به اعمال برای تغییر دادن حجم ریه هستند کاهش می دهد، ترکیب کار تنفسی بیشتر و اشکالات مکانیکی عضلات تنفسی که به دلیل پرهوایی ریه است می تواند در موارد تشدید انسداد راه های هوایی منجر به خستگی عضلات تنفسی و نارسایی ریه شود، چیزی که طی حمله ی حاد COPD با آسم اتفاق می افتد.
اسپیرومتری
علاوه بر شرح حال بالینی و معاینه فیزیکی در روند تشخیص بیمار مشکوک به بیماری انسدادی ریه، اسپیرومتری یک اقدام کلیدی است. گرچه اسپیرومتری در دسترس و ارزان است اما بلااستفاده مانده و به همین دلیل بیماری های انسدادی ریه کمتر تشخیص داده می شوند. ارزیابی پاسخ بالینی و پاسخ اسپیرومتری به برونکودیلاتور یک اقدام ساده و مفید در افتراق آسم از COPD است اندازه گیری ظرفیت انتشار مونواکسید کربن(DLCO) نیز در این افتراق مفید است. در آسم ظرفیت انتشار طبیعی یا افزایش یافته است در صورتی که در COPD به دلیل عدم وجود سطح مورد نیاز برای تبادل گاز، ظرفیت انتشار اغلب کاهش می یابد. ابزارهای پیچیده تری مثل توموگرافی کامپیوتری قفسه سینه با قدرت تفکیک بالا(HRCT) هم ممکن است برای تشخیص علل کمتر شایع بیماریهای انسدادی ریه مثل برونشکتازی به کار رود.
بیماری انسدادی مزمن ریه
تعریف و اپیدمیولوژی
حال حاض طرح جهانی برای بیماری های مزمن انسدادی ریه (COPD, (GOLD را اینطور تعریف می کند، یک بیماری قابل پیشگیری و قابل درمان شایع که مشخصه ی آن محدودیت غیر قابل برگشت جریان هوا است. بیماری معمولا پیشرونده بوده و با پاسخ التهابی افزایش یافته و مزمن راههای هوایی و ریه به ذرات سمی و گازها همراه است، وجود محدودیت جریان هوا با اسپیرومتری ثابت می شود. اگر نسبت حجم بازدمی با فشار در یک تانیه(FEV) به ظرفیت حیاتی با فشار(FVC) پس از تجویز یک برونکودیلاتور به کمتر از ۰.۷ برسد، نشان دهنده انسداد راه هوایی است.
اگر چه در گذشته COPD به معنی وجود آمفیزم (اتساع مرضی فضاهای هوایی دیستال ) یا برونشیت مزمن (یک سندرم بالینی که شامل سرفه و خلط برای حداقل سه ماه در هر سال در دو سال پیاپی است) بود، تعریف جدید آن بر اساس وجود محدودیت جریان هوا است و به وجود موارد ذکر شده، هم آمفیزم و هم برونشیت مزمن ممکن است با یا بدون محدودیت همزمان در جریان هوای بازدمی اتفاق بیفتند و بنابراین با هم همپوشانی دارند اما آنها مترادف COPD نیستند. تعریف جدید COPD وجود محدودیت دائمی و تجدید پذیر جریان هوای باردمی را برجسته می کند و بر سیر پیشرونده COPD و وجود التهاب غیر طبیعی در ریه ها و راه های هوایی تأکید می کند.

COPD در سراسر جهان بیماری شایعی است.
مطالعه ی Burden که جمعیت بزرگسال ۱۲ کشور را مورد بررسی قرار داد مشخص کرد که ۱۰ % از آنها پس از تجویز برونکودیلاتور حداقل انسداد متوسط راه هوایی را داشتند (۰.۷> FEV ، FEV / FVC کمتر از ۸۰ % قابل پیش) بینی میزان شیوع COPD با افزایش سن، سطح پایین اقتصادی اجتماعی و کشیدن سیگار متناظر می باشد. گرچه COPD در مردان شایع تر از زنان است اما شیوع COPD در زنان رو به افزایش است و میزان مرگ و میر سالانه در اثر COPD هم در زنان سفید پوست و هم زنان سیاه پوست روند افزایشی یکنواختی داشته است COPD بار اقتصادی قابل توجهی به هزینه های مراقبت های بهداشتی و از کار افتادگی وارد می کند .
در سال ۲۰۰۸ ، بیش از۸۲۰۰۰۰ مورد بستری در بیمارستان به دلیل COPD در آمریکا وجود داشته و بیماران COPD به دفعات از مراقبت های سرپایی و اورژانس استفاده کردند و بالاخره COPD نقش اساسی در مرگ و میر ناشی از بیماری های مزمن دارد. طبق گزارش COPD ، WHO چهارمین علت مرگ در سراسر جهان است.
چه موقعی COPD وجود دارد و به عواملی بستگی دارد؟
COPD اختلال پیچیده ای است که در اثر حساسیت به عوامل محیطی که ناشی از یک استعداد ژنتیکی است به وجود می آید. عامل محیطی اصلی سیگار است. اگر چه عوامل دیگری مثل آلودگی هوا، مواجهه با گرد و غبار بخارات، استنشاق دود ناشی از پخش غذا و وسایل گرمایی در خانه نیز دخیل می باشند، بین سیگاری ها می توانند به COPDمبتلا شوند و می شوند. این امر نقش عوامل خطری غیر از تنباکو را نشان می دهد.
استعداد ژنتیکی برای ابتلا به COPD از اثبات تجمع این بیماری در حانواده قابل استنباط است. اما تنها اختلال ژنتیکی که تا به حال به حال به طور قطع با COPD مرتبط دانسته شده، نقص -a آنتی تریپسین که ناشی از جهش هایی در ۱SERPINA بوده مسئول ۱ تا ۲ درصد از همه موارد COPD است. مطالعات جدید نواحی دیگری از ژنوم را نیز مشخص کرده که در استعداد به COPD نقش دارند.

چندین مطالعه ی طولی الگوی کاهش عملکرد ریه مرتبط با سن را تعیین و مفهوم استعداد ابتلا به COPD را تبیین کرده اند. این مطالعات نشان میدهند که بیشتر مردان بزرگسال غیرسیگاری هر سال کاهش ۳۵ تا ۴۰ میلی لیتری حجم بازدمی با فشار در یک ثانیه(FEV) را تجربه می کنند. میزان این کاهش سیگاری ها به ۴۵ تا ۶۰ میلی لیتر در سال بالغ می گردد. با این حال سیگاری های مستعد ممکن است از دست رفتن ۷۰ تا ۱۲۰ میلی لیتر در سال را تجربه کنند(شکل ۲-۱۶). این اطلاعات به پزشک امکان رسم میزان کاهش عملکرد ریه در بیماران مبتلا به COPD و ارزیابی اثرات مداخلات درمانی را فراهم می آورد.
پاتولوژی
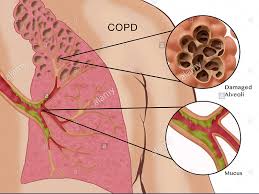
در ریه و مجاری هوایی افراد مبتلا به COPD تغییرات ساختمانی گوناگونی مشاهده می شود. تعریف جدید COPD روی نقش محوری التهاب مزمن در پاتوژنز COPD و در بروز سازماندهی مجدد( rernodeling) در ریه و مجاری هوایی تاکید می کنند. تغییرات ساختمانی مشاهده شده در COPD آمفیزم و اختلالات راه های هوایی کوچک و بزرگ هستد شواهد روزافزونی وجود دارد که نشان میدهد محل اصلی محدودیت جریان هوا و کانون اصلی پاتولوژی در COPD راه های هوایی کوچک است.
آمفیزم در COPD
آمفیزم طبق تعریف عبارت است از اتساع دایمی مجاری هوایی دیستال به برونشیول انتهایی، علت این امر، تخریب پارانشیم ریه در غیاب فیبروز قابل توجه می باشد. این تغییرات باعث به وجود آمدن یک حبابچه ی غیر طبیعی با قابلیت محدود برای تبادل گاز می گردند. براساس مقاطع نازک قابل مشاهده با چشم غیر مسلح از ریه می توان آمفیزم را به دو نوع مرکز لبولی و تمام لبولی تقسیم بندی کرد. در آمفیزم مرکز لبولی، بخش پروگزیمال لبول(برونشیول تنفسی) مبتلا می گردد که نمایانگر شایع ترین ویژگی بافت شناختی مشاهده شده در آمفیزم مرتبط با سیگار است در حالیکه آمفیزم تمام لبولی به طور بارز در نقص ۱a – آنتی تریپسین دیده می شود.
۱a- آنتی تریپسین
۱a- آنتی تریپسین یک مهارکننده ی سرین پروتئاز است که الاستاز آزاد شده از سلول های التهابی که قادر به تخریب ماده ی زمینه ای بافت همبند می باشند را، غیر فعال می کند. این مشاهده نقص a- آنتی تریپسین با آمفیزم ارتباط دارد و اینکه آمفیزم با تزریق پاپائین که یک پروتئاز است به داخل ریه ها در مدل های تجربی قابل بازآفرینی است منجر به این فرضیه گردید که علت آمفیزم عدم تعادل بین سیستم های پروتئاز و آنتی پروتئاز در ریه می باشد.
این عدم تعادل مفروض تمایل به تخریب بافت همبند ریه داشته و منجر به آمفیزم میگردد(فرضیه ی پروتئاز آنتی پروتئاز) تحقیقات روی الاستاز نوتروفیل و نقش آن در تخریب الاستین ریه تمرکز داشته است. الاستاز نوتروفیل هدف اصلی غیرفعال شدن توسط ۱a – آنتی تریپسین می باشد و در مقابل اثرات آن تقریبا مقاومت دیگری وجود ندارد. به هر حال شواهد حاکی از نقش اصلی این آنزیم در آمفیزم ناشی از دود سیگار کمرنگ تر شده اند.
در نتیجه دایره توجه گسترده شده تا مطالعه ی نقش متالو پروتئینازهای ماده ی زمینه ای ( MMPS ) تولید شده توسط ماکروفاژها و سایر سلول ها در آمفیزم را نیز در بر گیرد. موش های دستکاری شده از لحاظ ژنتیک که در ژن ۱۲ – MMP نقص دارند در برابر ایجاد آمفیزم مقاوم می باشند و پلی مورفیسم تک نوکلئوتیدی در ژن MMP12 با کاهش احتمال بروز COPD همراه است؛ این یافته ها از نقش این آنزیم در تخریب بافت همبندی ریه که منجر به آمفیزم میگردد حمایت می کند.
التهاب القاء شده توسط دود سیگار
التهاب القاء شده توسط دود سیگار آغازگر چرخه آزاد شدن پروتئاز و تخریب ریه است که منجر به آمفیزم می گردد. ماکروفاژها توسط دود سیگار فعال شده نوتروفیل ها و سایر سلول های التهابی را به ریه فرا می خوانند که منجر به آزادسازی الاستاز و سایر متالو پروتئازها می گردد. تخریب الاستین و سایر عناصر بافت همبندی در ریه به مرور زمان توسط این پروتئازها متقابلا باعث از دست رفتن برگشت ارتجاعی و تخریب ساختمان های حبابچه ای می گردد که مشخصه ی آمفیزم است.
دود سیگار حاوی تعداد زیادی مولکول اکسیدان با قابلیت القای استرس اکسایشی در ریه ها می باشد. استرس اکسایشی اثرات مختلفی دارد از جمله غیرفعال شدن آنتی پروتئازهای ریه به طریقه ی اکسایشی و نیز استیله شدن هیستون های خاص در کروماتین سلول های ریه و ماکروفاژها که به ژن های التهاب زای مختلفی اجازه بیان شدن می دهد، فعالیت هیستون داستیلاز در COPD کاهش می یابد که ممکن است متقابلا باعث ناتوانی در کنترل پاسخ التهاب را در این بیماری گردد.
ژن های التهاب زا
بیان ژن های التهاب زا باعث تولید و رهاسازی سیتوکین می گردد که آن هم به نوبه خود باعث فراخوانی بیشتر سلول های التهابی و فعال شدن آنها می گردد. التهاب سرتاسری که در اثر التهاب در جریان در ریه به راه می افتد ممکن است منجر به ناهنجاری های غیرریوی همراه با آمفیزم از جمله کاشکسی و تغییرات عضلات اسکلتی گردد. نهایتا افزایش آپوپتوز سلول های ریوی(پنوموسیت ها) و سلول های اندوتلیال در ریه ی دچار آمفیزم مشاهده شده و می تواند در از دست رفتن حبابچه ها دخیل باشد.
بهبود درک ما از آسیب زایی آمفیزم مرهون تایید این مطلب است که التهاب، استرس اکسایشی، تعادل پروتئاز- آنتی پرو تئاز و آپوپتوز در تعامل پیچیده ای که توسط دود سیگار القا می شود با هم مرتبط هستند. این بهبود درک ما طیف امکانات درمانی را که ممکن است در کندتر کردن روند تخریبی مؤثر باشند وسیع تر ساخته است. با این وجود، تا به امروز درمان های اختصاصی که مسیرهای مولکولی درگیر در آسیب زایی آمفیزم را هدف قرار داده اند در تعبیر پیشرفت بیماری موفق نبوده اند، احتمالا تنها استثنا جایگزین ساختن ۱α- آنتی تریپسین در درمان نقص ۱α – آنتی تریپسین بوده است.
عملا ۱α- آنتی تریپسین چه کاربردی در بدن دارد؟
۱α- آنتی تریپسین که یک واکنش گر مرحله ی حاد است عمدتا در کبد ساخته می شود و از آنجا به ریه ها نقل مکان کرده و در انجا الاستاز آزاد شده از سلول های التهابی را که قادر به تخریب ماده ی زمینه ای بافت همبند می باشد غیر فعال می کند. ۱α – آنتی تریپسین با این عمل از تخریب لیجام گسیخته ی الاستین در پارانشیم ریه جلوگیری کرده و در برابر ایجاد آمفیزم محافظت می کند. افراد دارای ژنوتیپ Z Z نقص ۱α- آنتی تریپسین، اشکال جهش یافته ی این آنزیم را تولید می کنند که تمایل به پلیمریزه شدن به صورت نامتناسب در درون سلول های کبد داشته و منجر به کمبود ۱α- آنتی تریپسین ترشح شده می گردند و در برخی موارد به علت تجمع آنزیم جهش یافته با آرایش غیر عادی در داخل سلول منجر به آسیب همزمان کبد می گردند.
بیمارانی که در سنین جوانی (زیر ۴۰ سال) دچار آمفیزم می شوند بدون در نظر گرفتن سیگاری بودن یا نبودن و نیز بیماران مبتلا به برونشکتازی و بیماری کبدی غیر قابل توجیه باید از نظر این بیماری مورد بررسی قرار گیرند. پلی مورفیسم سایر ژن هایی که به نظر می رسد با استعداد ابتلا به COPD مرتبط باشند در دست بررسی است.
آزمایش ، سطح پایین ۱α – آنتی تریپسین را نشان می دهد. تعیین ژنوتیپ، جهش های خاصی را می تواند آشکار کند(عموما ZZ در موراد کمبود شدید). پلی مورفیسم در ژن های دیگر(مثل MMP12) که به نظر می رسد با استعداد COPD مرتبط باشند ، مشخص نشده و عوامل دیگری که در وراثت استعداد به COPD نقش دارند نیز تحت بررسی دقیق هستند، جایگزین ۱α- آنتی تریپسین در بیماران مبتلا به کمبود آن استفاده شده و در ارزیابی با توموگرافی کامپیوتری مشخص شده که سبب کاهش از دست رفتن تراکم ریه (جایگزین آمفیزم) شده است(سطح یک شواهد)
بیماری راه های هوایی بزرگ و کوچک در COPD
برونشیت مزمن اغلب به طور همزمان با آمفیزم در بیمار مبتلا به COPD وجود دارد، اما ممکن است مستقل از آمفیزم با COPD هم وجود داشته باشد و از نظر بالینی تعریف شود قبلا توضیح داده شد. کشیدن سیگار عامل اصی می باشد گرچه مواجهه با آلاینده هایی مثل غبار و دودها نیز ممکن مسیرها ممکن است در واکنش دهی بیش از حد راه های هوایی دخیل باشند. گروهی از واسطه های شیمیایی درونزاد مثل پروتئازها ، عوامل رشد ، و سیتوکین ها نیز می توانند قوام طبق تعریف ، علامت غالب در برونشیت مزمن تولید است نقشی ایفا کنند . یافته های آسیب شناختی عبارتند از هیپرپلازی سلول های جامی، ترشح بیش از حد موکوس و انسداد توسط توپی های موکوسی، و التهاب و فیبروز راه های هوایی .
سازوکارهای بیماری زای دخیل در ایجاد آمفیزم در آسیب زایی برونشیت مزمن نیز حایز اهمیت می باشند. با این وجود، برخلاف آمفیزم، برونشیت مزمن بیماری راه های هوایی بزرگ است و نه پارانشیم ریه. به همین سبب، ارتباط برونشیت مزمن با انسداد در برابر جریان هوا ضعیف تر آمفیزم است و محدودیت جریان هوا در بیماران مبتلا به برونشیت مزمن ممکن است بیشتر منعکس کننده ی همراهی با آمفیزم و بیماری راه های هوایی کوچک باشد.
التهاب در برونشیت مزمن منجر چه تاثیزاتی است؟
التهاب در برونشیت مزمن منجر به تأثیر روی اپی تلیوم راه های هوایی از جمله تولید بیش از حد موکوس و اختلال پاکسازی مژک های مخاطی می گردد. تحریک های عصب زاد نیز در بیماری زایی انسداد راه هوایی برونشیت مزمن اهمیت دارند راه های هوایی هدایت کننده، توسط عضلات صاف احاطه شده اند که حاوی گیرنده های آدرنرژیک وکولینرژیک هستند. تحریک گیرنده های, ۲B- آدرنژیک توسط کاتکول آمین های در گردش، راه های هوایی را گشاد میکند؛ حالیکه تحریک گیرنده های حساس به مواد تحریک کننده با سازوکار کولینرژیک و از طریق عصب واگ، راه های هوایی را منقبض می کند، مسیرهای تحریکی منقبض کننده ی برونش در حالت عادی برای محافظت در برابر استنشاق عوامل مضر عمل می کنند اما در وضعیت های مرضی این راه های هوایی دخیل باشند.
گروهی از واسطه های شیمیایی درونراد مثل پروتئاز ها، عوامل رشد، و سیتوکین ها نیز می توانند قوام راه های هواییرا تحت تأثیر قرار دهند.طبق تعریف، علامت غالب در برونشیت مزمن تولید خلط است. اسپاسم برونش نیز ممکن است برجسته باشد. عفونت های باکتریایی راجعه ی راه های هوایی معمول می باشند. همانند تمام بیماران مبتلا به COPD ارزیابی بیماران مبتلا به برونشیت مزمن علاوه بر آزمایشات استاندارد باید شامل آزمون های عملکرد ریه و یک عکس سینه باشد.

نقش آسیب راه های هوایی کوچک
آسیب راه های هوایی کوچک (قطر < ۲ میلی متر) یک نقش مکمل در آسیب زایی COPD دارد. راه های هوایی کوچک محل اصلی مقاومت در برابر جریان هوا در COPD هستند. برونشیولیت تنفسی همراه با تجمع ماکروفاژهای رنگدانه دار در درون و اطراف برونشیول ها ممکن است یک یافته اتفاقی در سیگاری های بدون علامت که به COPD مبتلا نیستند باشد. به هر حال، با ایجاد COPD سایر سلول های التهابی احتمالا در واکنش به تحریک در جریان توسط دود سیگار یا ذرات استنشاقی، به راه های هوایی هدایت کننده کوچک فراخوانده می شوند. در COPD راه های هوایی کوچک تحت تأثیر التهاب دچار سازمان دهی مجددا می شوند که منجر به ضخیم شدگی و فیبروز دیواره راه های هوای ، هیپرتروفی عضلات صاف، و تنگی داخل مجرایی راه های هوایی می گردد که مسؤول انسداد در برابر جریان هوا می باشد. راه های هوایی کوچک می توانند توسط توپی های موکوسی و اگزودای التهابی مسدود کردند که منجر به افزایش مقاومت در برابر جریان هوا می شود.
در حال حاضر اثبات کاهش وسیع در تعداد راه های هوایی کوچک و سطح مقطع در ریه افراد مبتلا به COPD شواهد مهمی مبنی بر این فراهم کرده است که شدت از دست رفتن راه های هوایی کوچک آنقدر هست که سبب بروز محدودیت جریان هوا در اسپیرومتری(مشخصه ی COPD) شود. بنابراین شواهد در COPD از بین رفتن راه های هوایی کوچک ممکن است پیش از وقوع آمفیزم رخ دهد.
در COPD اختلالات ایمنی هم در سطح راه های هوایی کوچک دیده می شود. ممکن است فولیکول های لنفاوی در پاسخ به تحریک آنتی ژنی در جریان و عفونت باکتریایی، در اطراف راه های هوایی شکل گیرند؛ در COPD پیشرفته تر غلبه با سلول های B و ۸+CD می باشد. آمفیزم با تخریب حبابچه های متصل به راه های هوایی که در حالت عادی نیرویی در مقابل بسته شدن راه های هوایی ایجاد می کند باعث انسداد در برابر جریان هوا در سالح راه های هوایی کوچک می گردد. این تغییرات در سطح راه های هوایی کوچک در ایجاد ناهنجاری های فیزیولوزیک و تغییر پاسخ ایمنی موضعی در COPD دخیل می باشند.
تظاهرات بالینی
مشخصه ی COPD مرتبط با قرار گرفتن در معرض تنباکوه تنگی نفس با پیشرفت آهسته است که در ابتدا حین فعالیت مورد توجه قرار می گیرد اما در طی سالیان پیشرفت می کند تا جایی که با حداقل فعالیت(مثلا موقع لباس پوشیدن) نیز آشکار می گردد. افراد مبتلا از عدم تحمل به ورزش و خستگی شکایت دارند و نهایتا بیماری منجر به کاهش وزن، افسردگی و اضطراب ناشی از افزایش کار تنفس می گردد. سرفه مزمن ممکن است وجود داشته و بسته به درجه متاپلازی موکوسی(مثلا برونشیت مزمن) همراه با تولید خلط یا خشک باشد، در کل، آمفیزم ناشی از استعمال مزمن سیگار تقریبا هرگز در بیماران زیر ۴۰ سال دیده نمی شود.
در صورت مشاهده آن در بیمار زیر ۴۰ سال باید بیماری های ژنتیک مانند نقص ۱α- آنتی تریپسین مد نظر قرار گیرد در مراحل اولیه COPD ممکن است معاینه فیزیکی طبیعی باشد، معاینه طبیعی و فقدان علایم اغلب تشخیص را به تأخیر می اندازد. ممکن است مشاهده و لمس قفسه سینه از نشان دادن یافته ها عاجز باشند. با پیشرفت بیماری ممکن است ریه ها در دق پرطنین باشند، و سمع ریه ها کاهش صداهای تنفسی همراه با خرخره یا خس خس، نشان دهد. ممکن است قفسه ی سینه شروع به تغییر شکل کرده و به بیمار ظاهر سینه بشکه ای بدهد.
در مراحل انتهایی COPD شاهد چه علایم در بیماران هستیم؟
در مراحل انتهایی COPD بیماران شواهدی از افزایش کار تنفس مثل استفاده از عضلات فرعی، تنفس با لب های برگشته به خارج، و کاهش وزن نشان می دهند. تحلیل رفتن عضلات اسکلتی نیز ممکن است آشکار شود. علیرغم نارسایی تنفسی شان، برخی بیماران تا مراحل دیررس بیماری قادر به حفظ سطوح نسبتا طبیعی اکسیژن در خونشان هستند که منجر به تابلوی بالینی کلاسیک پف کننده صورتی می گردد. سایر بیماران تمایل به احتباس CO2 و کاستن از کار تنفس دارند که منجر به اسیدوز تنفسی مزمن، و در موارد شدید، پلی سیتمی و سیانوز می گردد. این وضعیت نمونه بارز فنوتیپ ساردین آبی می باشد. COPD با سایر بیماری های تنفسی مثل آپنه انسدادی خواب هم همپوشانی دارد که به احتباس۲ Co کمک می کند.
گرچه COPD منجر به تنگی نفس مزمن پیشرونده می گردد اما تشدیدهای حاد دورهای مشخصه این بیماری می باشد. مشخصه تشدید بیماری ، وخامت سریع علایم تنفسی و عملکرد ریوی مثل سرفه و تولید خلط می باشد . تشدید حاد با علل مختلفی ، عمدتا عفونت های تنفسی ویروسی یا باکتریایی ، آلودگی هوا با سایر عوامل محیطی ، آمبولی و نارسایی قلب مرتبط می باشد. تشدید بیماری با افزایش شدت بیماری، افزایش سن و در طی ماه های زمستان بیشتر اتفاق می افتد.
شدت وخامت این بیماری به چه صورت است؟
شدت وخامت بسیار متنوع است اما وخامت شدید ممکن است منجر به بستری شدن، نارسایی حاد تنفسی و مرگ گردد، به دنبال یک بار تشدید بیماری، ممکن است هفته ها به طول انجامد تا بیمار به سطح عملکردی پایه بازگردد. به نظر می رسد بیمارانی که به دفعات دچار تشدید COPD می گردند کاهش تسریع شده FEV را تجربه می نمایند. بیمارانی که یک بار تشدید COPD را تجربه می کنند احتمال اینکه در آینده دوباره دچار حمله حاد شوند بیشتر می شود، این امر نشان دهنده این است که تشدید بیماری یک واقعه مهم در اسیر بیماری COPD است. گاهی در بیماری که دچار تشدید بیماری و نارسایی حاد تنفسی متعاقب آن شده، COPD برای اولین بار تشخیص داده می شود.
COPD با عوارض و بیماری هایی مثل آترواسکلروز عروق قلبی، سرطان ریه، استئوپورز و افسردگی همراه است دلیل این بیماری ها ممکن است سیگا، التهاب سیستمیک مزمن دراختلالی COPD که در کیفیت زندگی بیماران با درمان های به کار رفته در طی بیماری می باشد (میل کورتیکواستروئیدها). پیگیری و درمان مناسب این عوامل جزء مهمی از درمان بیماران COPD است.

با پیشرفت بیماره چه اتفاقاتی می افتد؟
با پیشرفت بیماری، حجم های روی افزایش یافته(پرهوایی) و دیافراگم مسلح می گردد که باعث ناکارآمد شدن بیرون زدگی دیافراگم در حین دم می گردد. حجم جاری (TV) کاهش یافته و سرعت تنفس در تلاش برای کاستن از کار تنفس افرایش می یابد. در بیماری پیشرفته به علت ار بین رفتن عروقی در دیواره های تخریب شده ی حبابچه ها سازماندهی مجدد عروق ناشی از هیپوکسی مزمن، سیستم قلبی عروقی نیز تحت تاثیر قرار می گیرد. با محدودیت فضا برای جاری شدن خون، مقاومت روی روی افزایش یافته و منجر به افزایش پس بار بطن راست و پرفشاری ریوی می گردد. این امر پیدایش نارسایی بطن راست را تسریع می کند که در زمینه بیماری ریوی به آن قلب روی اطلاق می گردد. مشخصات قلب روی (کو پولمونل ) عبارتند از گالوپ بطن راست ، وریدهای متسع گردن، پس زنش کبدی-وداجی، و ادم پا ها.
تشخیص و تشخیص افتراقی
در کل، بیماریهای برونشیولی باعث یک الگوی محدودیت جریان هوای بازدمی در آزمونهای عملکرد ریوی بدون شواهدی از قابل برگشت بودن میشوند. سندرم برونشیولیت انسدادی به صورت بالینی با کاهش ۲۰ درصدی FEV۱ از یک مقدار پایه در آزمونهای پیاپی پس از انجام پیوند ریه تشخیص داده میشود. HRCT در تشخیص و ارزیابی بیماریهای برونشیولی ارزشمند است. یافته شاخص در HRCT شامل ندولهای مرکز لوبولی یا کدورتهای درخت غنچه کرده میباشد که منعکس کننده اگزودای التهابی فشرده شده با سلولهای اپیتلیال ریزش یافته در برونشیولها میباشد.
اغلب یک الگوی موزائیک با کاهش انرژی پرتو در نواحی جغرافیایی ریه که منعکس کننده به دام افتادن هوا دیستال به برونشیولهای مسدود شده میباشد دیده میشود و سی تی اسکن حین مرحله بازدم میتواند مسجل کند که این یافته به علت به دام افتادن هوا میباشد به کاهش خونرسانی ناشی از بیماری عروق ریوی، به علت طبیعت تک تکه و پراکنده ناهنجاریهایی که در بیماریهای برونشیولی وجود دارند اغلب نمونهبرداری از ریه ارزش زیادی ندارد. تشخیص افتراقی اختلالات برونشیولی COPD است که برگشت پذیری ضعیفی را در اسپیرومتری نشان میدهد.
درمان
درمان بیماریهای برونشیولی چالش برانگیز است. برونشیولیت حاد به طور معمول بدون درمان بهبود مییابد گرچه اغلب گشادکنندههای برونش و استروئیدها تجویز میشوند اما سودمندی آنها واضح نیست. سندرم برونشیولیت انسدادی پاسخ ضعیفی به افزایش سرکوب ایمنی میدهد و یکی از علل شایع مرگ پس از پیوند است. طبق گزارش آزیترومایسین که یک آنتی بیوتیک ماکرولید است باعث افزایش FEV۱ در سندرم برونشیولیت انسدادی میگردد همچنین گزارش شده است که آنتی بیوتیکهای ماکرولید اثر مثبت روی سیر بالینی پان برونشیولیت منتشر دارند که احتمالاً منعکس کننده اثرات تعدیل کننده ایمنی با ضد فیبروزی این داروها میباشد (در سطح ۲ شواهد)، ممکن است پیوند ریه در سندرم برونشیولیت انسدادی پیشرونده ضروری باشد و گهگاه پیوند ریه در بیماران مبتلا به سندرم برونشیولیت انسدادی پس از رد پیوند انجام شده است.
منابع
Bulst As, McBurnie MA, Vollmer WM, et al, on behalf of the BOLD Collaborative Research Group International variation in the prevalence of COPD (the BOLD Study) a population-based prevalence study, Lancet 370741-750, 2007.
Burgel P-R, Bergeron A. de Blic I. et al: Small airways diseases, excluding asthma and COPD: an overview, Bar Respir Rev 22:131-147, 2013.
Decramer M. Janssens W, Miravitlles M: Chronic obstructive pulmonary disease, Lancet 37:1341-1351, 2012.
Global Intative for Asthma: GINA report: global strategy for asthma management and prevention (updated 2012), Available at: www.ginasthma.org. Accessed August 29, 2014.
Global Initiative for Chronic Obstructive Lung Disease: Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease (updated 2013), Available at: www.goldcopd.org. Accessed August 29, 2014.
Kim V, Criner GJ: Chronic bronchitis and chronic obstructive pulmonary disease, Am J Respir Crit Care Med 187-228-237, 2013.
King PT The pathophysiology of bronchiectasis, Int J COPD 4:411-419, 2009.
McDonough JE, Yuan R, Suzuki M, et al: Small airway obstruction and emphysema in chronic obstructive pulmonary disease, N Engl J Med 365:1567-1575, 2011, Mogayzel PJ, Naureckas ET, Robinson KA, et al: and the Pulmonary Clinical Practice Guidelines Committee: Cystic fibrosis pulmonary guidelines: chronic medications for maintenance of lung health, Am J Respir Crit Care Med 187 :680-689, 2013.
Pasteur MC, Bilton D, Hill AT) on behalf of the British Thoracic Society Bronchiectasis (Non-CF) Guideline Group British Thoracic Society guideline for non-CF bronchiectasis, Thorax 65:11-158, 2010.

۰۹۱۴۳۱۳۷۷۷۱ | ۰۴۱۳۳۳۷۹۹۳۴







